식약처, 올해 활발한 의료제품 허가 예고
1월 첫주 무려 106개 품목 승인 ... 평소 대비 3배 이상
식품의약품안전처가 새해들어서도 활발한 의료제품 인허가를 예고했다.
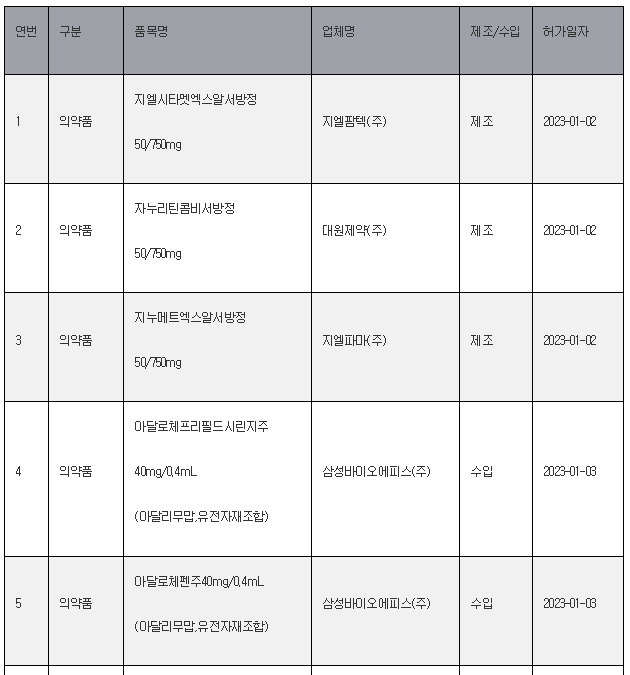
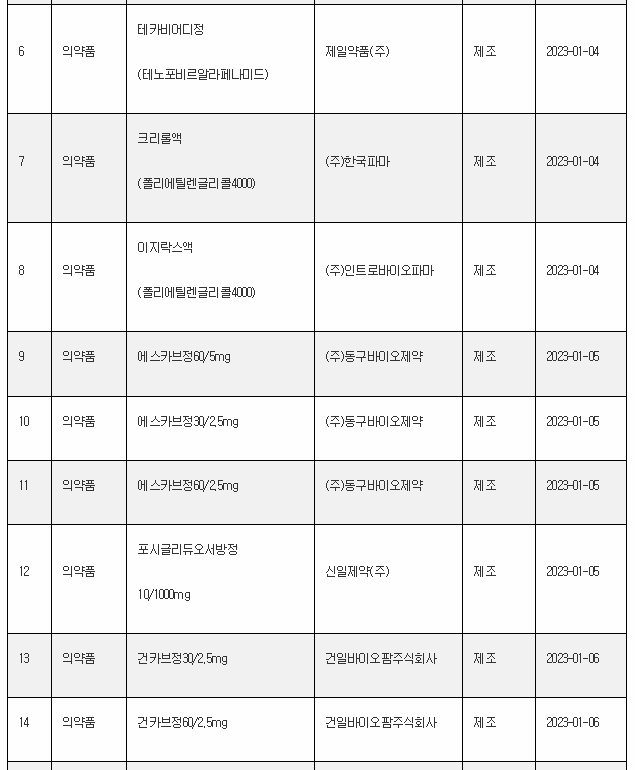
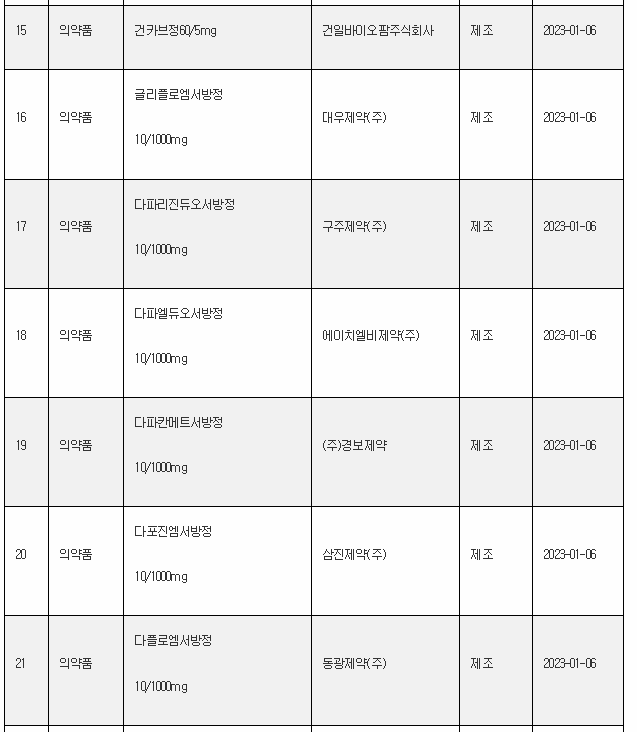
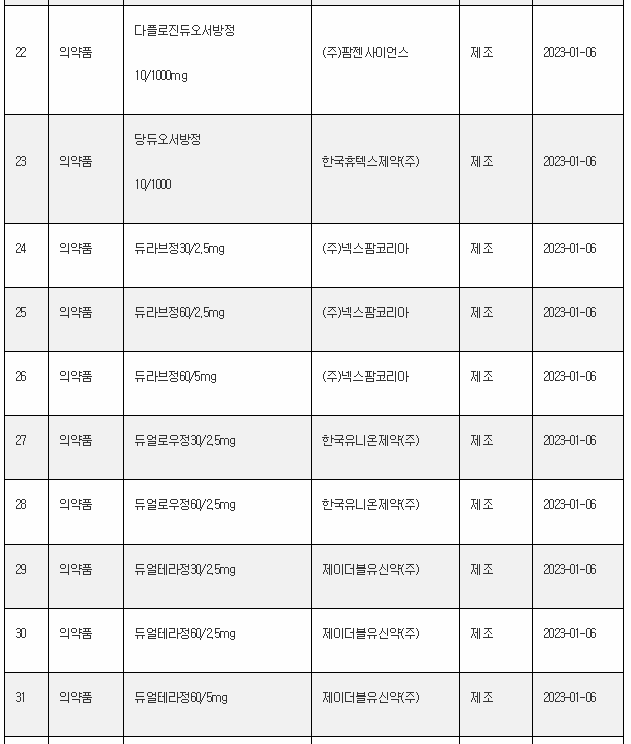
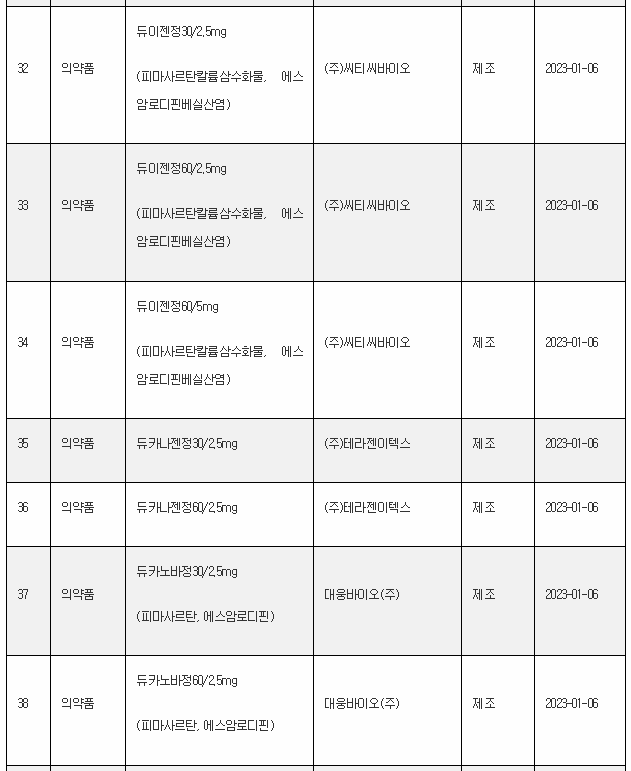
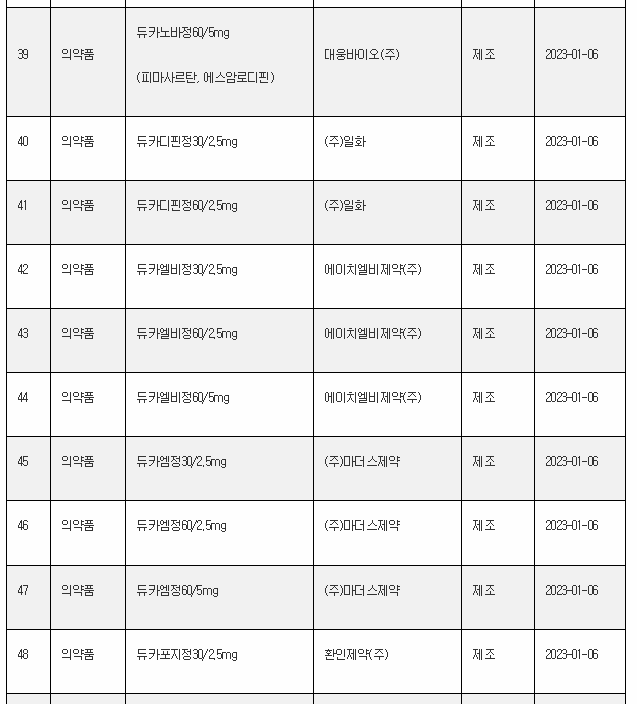
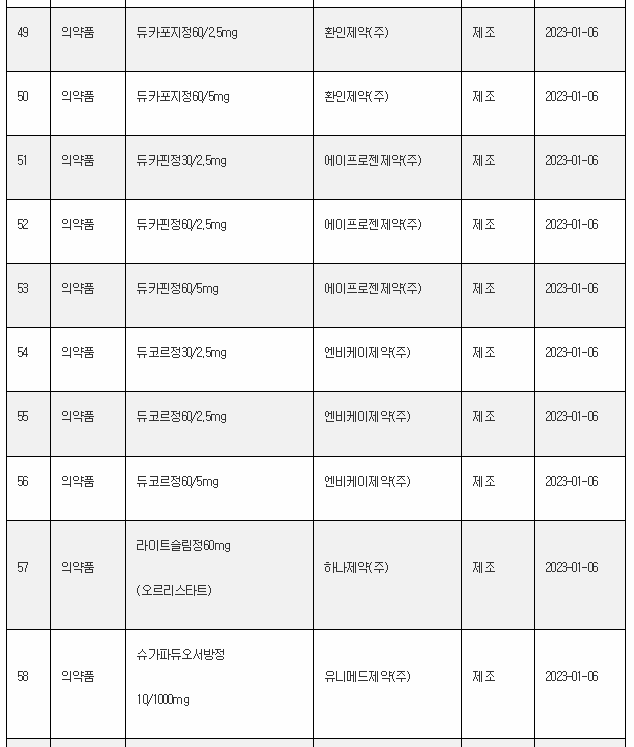
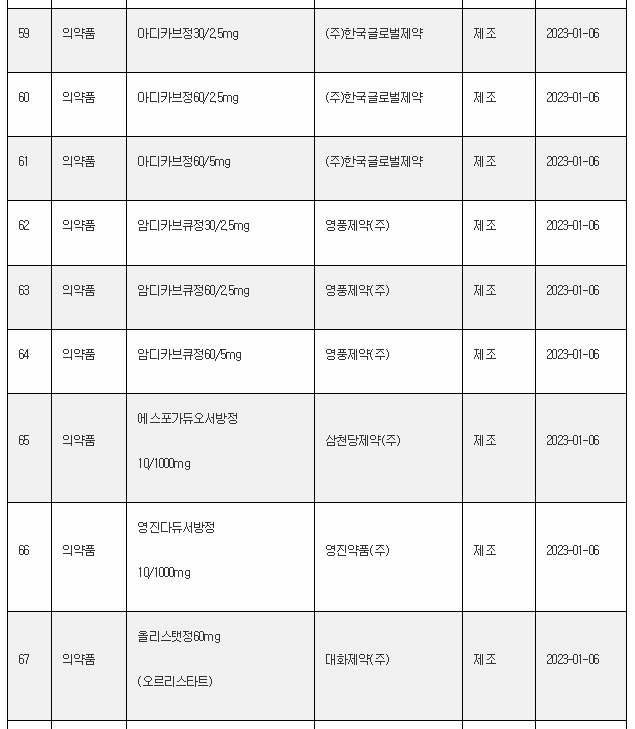
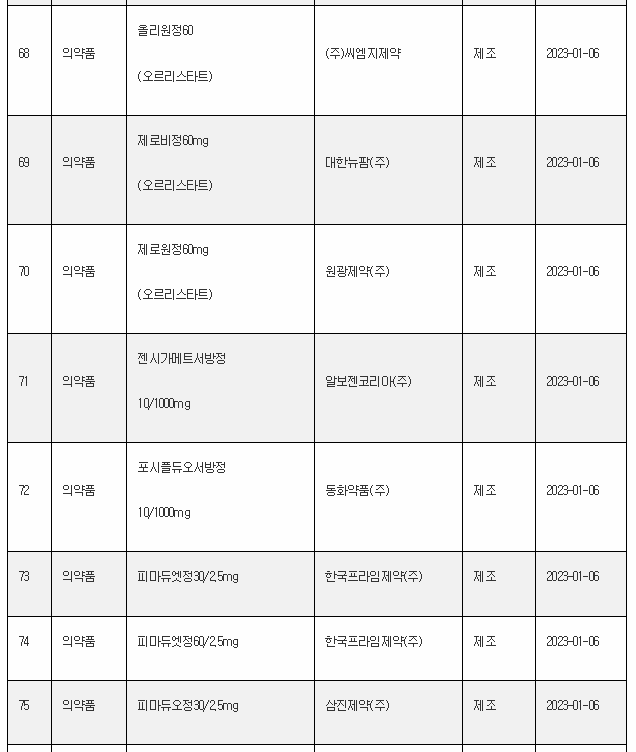
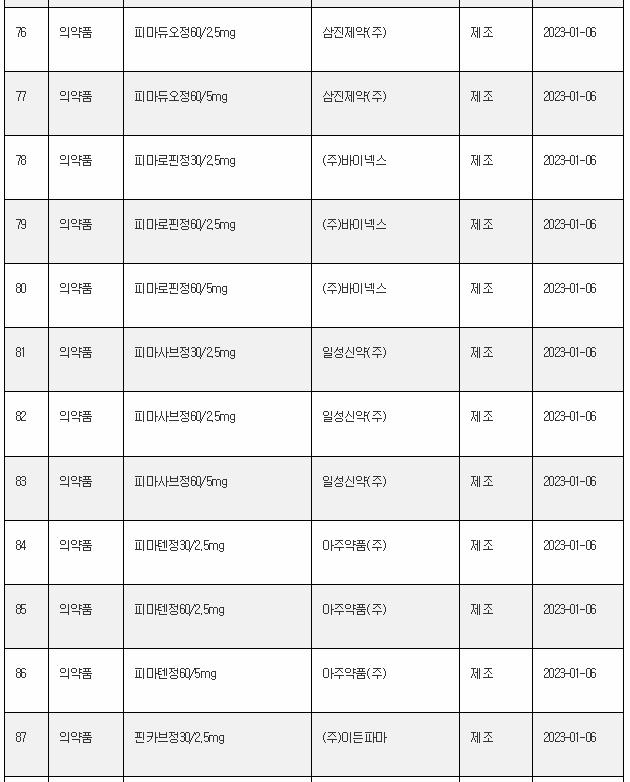
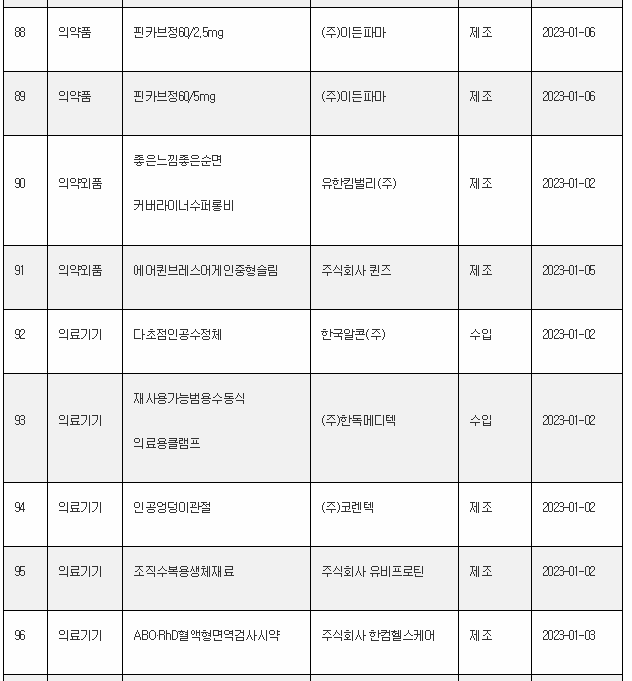
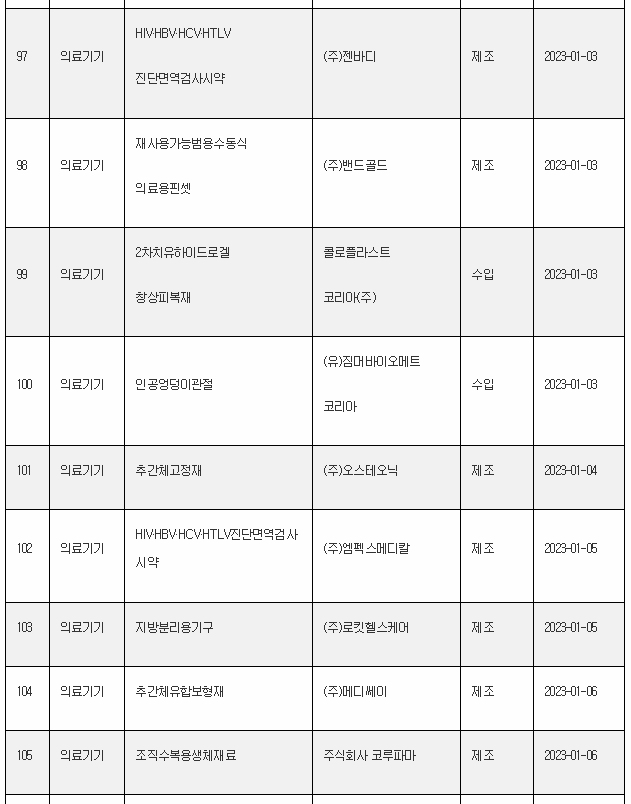
11일 식약처 전자민원시스템을 보면, 식약처는 올해 첫주인 1월 1일~1월 8일 사이 무려 106개 의료제품을 허가한 것으로 나타났다. 이는 한주에 많아야 20~30개에 불과한 평소의 허가 건수를 크게 웃도는 것이다.
1월 첫주 허가품목은 의약품 89개, 의약외품 2개, 의료기기 15개 품목 등이었다.
‘아달로체프리필드시린지주40mg/0.4mL’와 ‘아달로체펜주40mg/0.4mL’
지난주 허가된 대표적 의약품은 삼성바이오에피스의 ‘아달로체프리필드시린지주40mg/0.4mL’와 ‘아달로체펜주40mg/0.4mL’ 이다. 이들 약물은 류마티스관절염, 강직성 척추염, 크론병 등 자가면역질환의 치료에 사용되는 유전자재조합 동등생물의약품(바이오시밀러) 이다. 오리지널은 미국 애브비(Abbvie)의 자가면역질환 치료제 ‘휴미라’(Humira, 성분명: 아달리무맙·adalimumab)로, 이번 제품은 기존에 출시된 ‘아달로체’의 저용량 제제이다. <아래 관련기사 참조>
‘휴미라’는 지난 2012년 출시 이후 전세계에서 가장 많이 판매된 글로벌 1위 제품으로, 이후 9년째 줄곧 1위 자리를 놓치지 않았던 초대형 블록버스터다. 2021년에는 코로나19 대유행으로 인해 백신에게 한 자리 내주었지만, 207억 달러(3일 기준 환율 한화 약 26조 4753억 원)의 매출을 기록했다.
‘휴미라’의 물질 특허가 지난 2016년 12월에 만료됨에 따라 국내 제약바이오 업체들은 20조 원 규모의 ‘휴미라’ 바이오시밀러 시장을 선점하기 위해 앞다퉈 개발에 뛰어들었다. 대표적 기업은 삼성바이오에피스와 셀트리온이다.
이 중 가장 먼저 국내 시장에 깃발을 꼽은 곳은 삼성바이오에피스다. 이 회사는 지난 2017년 9월, 식약처로부터 ‘휴미라’의 국내 첫 번째 바이오시밀러 ‘아달로체’ 품목 허가를 받았다. 당시 허가된 ‘아달로체’ 용량은 40mg/0.8ml의 프리필드시린지주 및 프리필드펜주였다. 삼성바이오에피스는 애브비와 라이센스 합의 끝에 지난 2021년 유한양행과 맞손을 잡으며 ‘아달로체’를 국내에 공식 출시했다.
이후 셀트리온도 2021년 10월, ‘휴미라’의 바이오시밀러 ‘유플라이마’의 품목 허가를 받아 시장에 출시했다.
의료기기 중에서는 백내장 수술 시 수정체를 대체하는 의료기기인 할국알콘의 ‘다초점 인공수정체’가 관심을 끌었다.
의료제품 허가심사에 대한 투명성과 신뢰성을 강화하기 위해 지난해 10월부터 매주 의료제품 허가현황을 전자민원시스템을 통해 공개하고 있다.
아래는 1월 1주에 승인된 의료제품 리스트이며, 최근의 의약품 개발 트렌드를 읽을 수 있다.
https://www.hkn24.com/news/articleView.html?idxno=331297