식약처, 올해 의약품 정책 키워드는 '기간 단축'
|
신약 허가 수수료 인상...허가 전 사전상담 2건 이뤄져 |
|
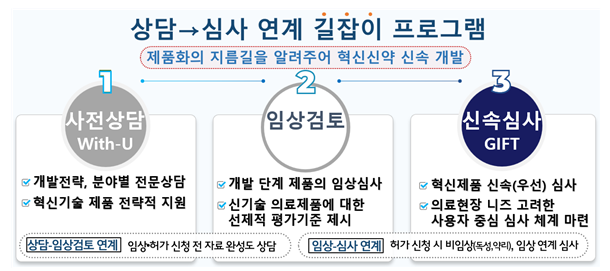
개발부터 제품화까지 '길잡이 프로그램' 운영 |
식품의약품안전처가 올해 발표한 업무 추진 계획을 보면 신약, 혁신제품 등의 빠른 시장 진입을 위한 지원 정책이 눈에 띈다.
식약처가 21일 공개한 '2025년 식약처 주요 정책 추진계획'을 보면 다양한 제도를 활용해 개발부터 제품화까지 기간을 단축하겠다는 뜻이 내포됐다.
첫 번째로 올해부터 전담 심사팀을 신설해 허가 단계별 전문 상담 서비스를 제공한다.
신약 허가 수수료가 4억1000만원으로 증가한 대신, 자료심사, GMP 실사 등을 우선 실시해 허가기간을 420일에서 295일로 단축하겠다는 계획이다.
이 과정에서 대면상담 횟수를 확대(3→10회)하고 보완이 필요한 자료는 일부 보완되는 대로 먼저 검토하는 수시검토 절차를 신설한다.
의·약사 등 역량 높은 심사인력 비중을 지속 확대(31→70% 목표)하고, 최신기술 분야 교육프로그램 확충과 심사자의 경력단계별 맞춤형 교육(기본·핵심·심화)으로 심사인력의 전문성과 규제역량을 제고한다.
특히 신약 품목허가를 접수하기 이전 사전상담을 1회에 한해 신청할 수 있는데, 현재까지 2건의 사전상담이 이뤄진 것으로 확인됐다.
김상봉 의약품안전국장은 20일 열린 백프리핑에서 "오늘 현재까지 2건의 사전상담을 진행했다"며 "다만 따로 신약 허가 신청이 접수된 건수는 없다"고 했다.
김 국장은 "미국, 유럽 등 의약 선진국의 신약 평가 수준과 대등하다고 평가 받는 수준의 절차를 만들어 문서화 해서 공개했다"며 "공개된 프로세스를 제대로 작동하기 위해 심사관을 적절히 배정하고, 고역량 전문 인력 확충도 진행할 것"이라고 밝혔다.
여기에 올해부터는 국가연구개발사업 중 혁신제품 개발연구를 선정해 규제 요건과 절차, 제품화 전략을 제공하는 규제정합성 검토 제도를 4월부터 본격 운영한다.
https://www.dailypharm.com/Users/News/NewsView.html?ID=319780