제약사, 약 공급 중단 180일 전에 보고해야… 신약·의료기기 허가 가속
올해부터 식품의약품안전처와 건강보험심사평가원이 의료기기 허가와 신기술 확인 절차를 동시에 진행한다. 기존에는 의료기기 허가 후 신의료기술 평가를 받아야 했는데, 이를 통해 별도의 평가 없이 즉시 시장에 진입할 수 있게 된다.
오는 4월부터 의약품 제조사·수입업체는 의약품 공급 중단 180일 전에 식약처에 사전 보고해야 한다. 환자의 치료 기회를 넓히고 혁신 신약의 허가를 당기고자 식약처 내 전담 심사팀을 신설한다. 이를 통해 신약 허가 기간을 기존 420일에서 295일로 줄인다는 방침이다.
식약처는 이런 내용을 담은 ‘2025년 주요 정책 추진계획’을 21일 발표했다. 오유경 처장은 “급변하는 사회·기술 환경에 대응해 국민이 체감할 수 있는 안전 정책과 효율적인 규제 체계를 구축하는 데 중점을 뒀다”며 “식약처는 국민 모두의 안전한 일상을 굳건히 지켜 나가는 성숙한 안전관리 체계 마련에 최선을 다할 것”이라고 강조했다.
◇프로포폴 셀프 처방 금지… 비만약 불법 유통 집중 점검
2월부터 의료인이 자신에게 프로포폴을 처방하는 것을 금지한다. 마약류통합관리시스템에 수집되는 처방량, 처방 건수 등 빅데이터를 분석해 중복·과다 처방이 의심되는 의료기관을 선별적으로 점검하며, 동물병원의 의료용 마약류 취급 보고 감시도 강화한다.
6월부터 의료인의 처방 전 환자의 투약 내역 확인 대상도 기존 ‘펜타닐’에서 ‘메틸페니데이트(ADHD 치료제)’, ‘식욕억제제’까지 단계적으로 확대된다.
이와 함께 하수종말처리장에서 실시하던 마약류 하수 역학 조사를 마약류 유입량이 많을 것으로 예상되는 지점까지 확대하고, 조사 결과 추정 사용량이 높은 지역은 불법 마약류 사용에 대한 단속・예방을 집중한다.
식약처는 위고비와 마운자로 같은 인기 비만 치료제의 온라인과 의료기관의 불법 유통・판매, 허위・과대광고를 집중적으로 점검할 방침이다. 숙취 해소 표방 식품은 인체적용시험을 통해 과학적 자료를 갖춘 경우에만 숙취 해소 표시・광고를 허용하는 ‘숙취 해소 실증제’도 이달 시행한다.
◇의약품 공급 달리면 보고해야… 국가 필수의료기기 도입
해열제·감기약 품절 사태 같은 의약품 수급 불안을 해소하기 위한 의료제품 공급망도 구축한다.
4월부터 의약품 제조·수입업체의 제조・수입 등 공급 중단 사전 보고 시점을 ‘중단 전 180일’로 앞당기고, 공급 부족 시에도 보고하도록 의무화한다. 의약품 수급을 신속히 예측하고 대비하기 위한 취지다.
10월에는 의료 현장 필수의료기기의 안정적인 공급을 위해 ‘국가필수의료기기’ 제도도 도입할 계획이다. 식약처는 기존 기술로는 치료가 어려운 중증질환자 등의 치료 기회 보장을 위해 임상시험 중인 치료 목적 의료기기 현황을 공개하고 사용 신청 절차 등도 구체화할 것이라고 설명했다.
◇신약 허가 심사 단축
신약 허가·심사 체계도 바뀐다. 식약처는 전담 심사팀을 신설해 허가 단계별 전문 상담 서비스를 제공한다.
신약은 자료 심사, GMP 실사 등을 우선 시행해 허가 기간을 420일에서 295일로 단축한다는 방침이다. 대면 상담 횟수를 늘리고, 보완이 필요한 자료는 일부 보완되는 대로 먼저 검토하는 ‘수시 검토 절차’도 신설한다.
식약처는 의·약사 등 역량 있는 심사 인력 비중을 기존 31%에서 70%로, 지속적으로 확대하겠다는 목표도 제시했다. 최신 기술 분야 교육 프로그램 확충과 심사자의 경력 단계별 맞춤형 교육(기본·핵심·심화)으로 심사 인력의 전문성과 규제 역량도 높인다.
◇의료기기·혁신 제품 시장 진입 가속
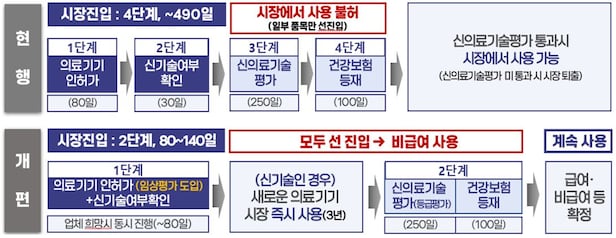
그동안 의료기기 허가 후 신기술 확인·신의료기술평가·급여 평가를 거쳐 시장에 진입했는데, 올해부터 의료기기 허가(식약처)와 신기술 확인(건강보험심사평가원) 절차를 동시 진행해 즉시 시장 진입할 수 있게 된다. 시장 진입 후 신의료기술평가를 실시하는 식이다.
이와 함께 신기술 의료기기의 안전성 강화를 위해 임상시험·경험·문헌 등을 종합적으로 검토하는 국제 수준의 임상 평가 제도를 도입한다. 이 제도는 디지털 의료기기부터 모든 혁신 의료기기까지 확대 적용된다.
세계 최초로 디지털 기술 적용 의료 제품의 규제 지원 법령 체계를 정한 ‘디지털의료제품법’이 1월 시행돼, 제품별 특성을 반영한 평가, 인력 양성, 연구개발(R&D) 등 디지털 의료 제품의 상용화를 지원한다.
오는 4월부터 국가연구개발사업 중 혁신 제품 개발 연구를 선정해 규제 요건과 절차, 제품화 전략을 제공하는 ‘규제 정합성 검토’ 제도를 본격 운영한다. 유전자 진단 기술, 항체-약물 복합 치료제 등 신기술 제품 개발을 지원하기 위해 허가 가이드를 제시하고, 임상·허가 등 규제 단계별 사전 상담부터 신속심사까지 연계하는 ‘길잡이 프로그램’을 운영해 혁신 제품의 시장 진입을 촉진할 계획이다.