유전자 가위 기술 활용 'ATTR-CM' 치료제 3상 승인
|
균상식육종 피부 T세포 림프종 국소 치료제 '레가다' 허가 인텔리아, 리제네론과 NTLA-2001 공동개발…생체 내에서 유전자 편집 |
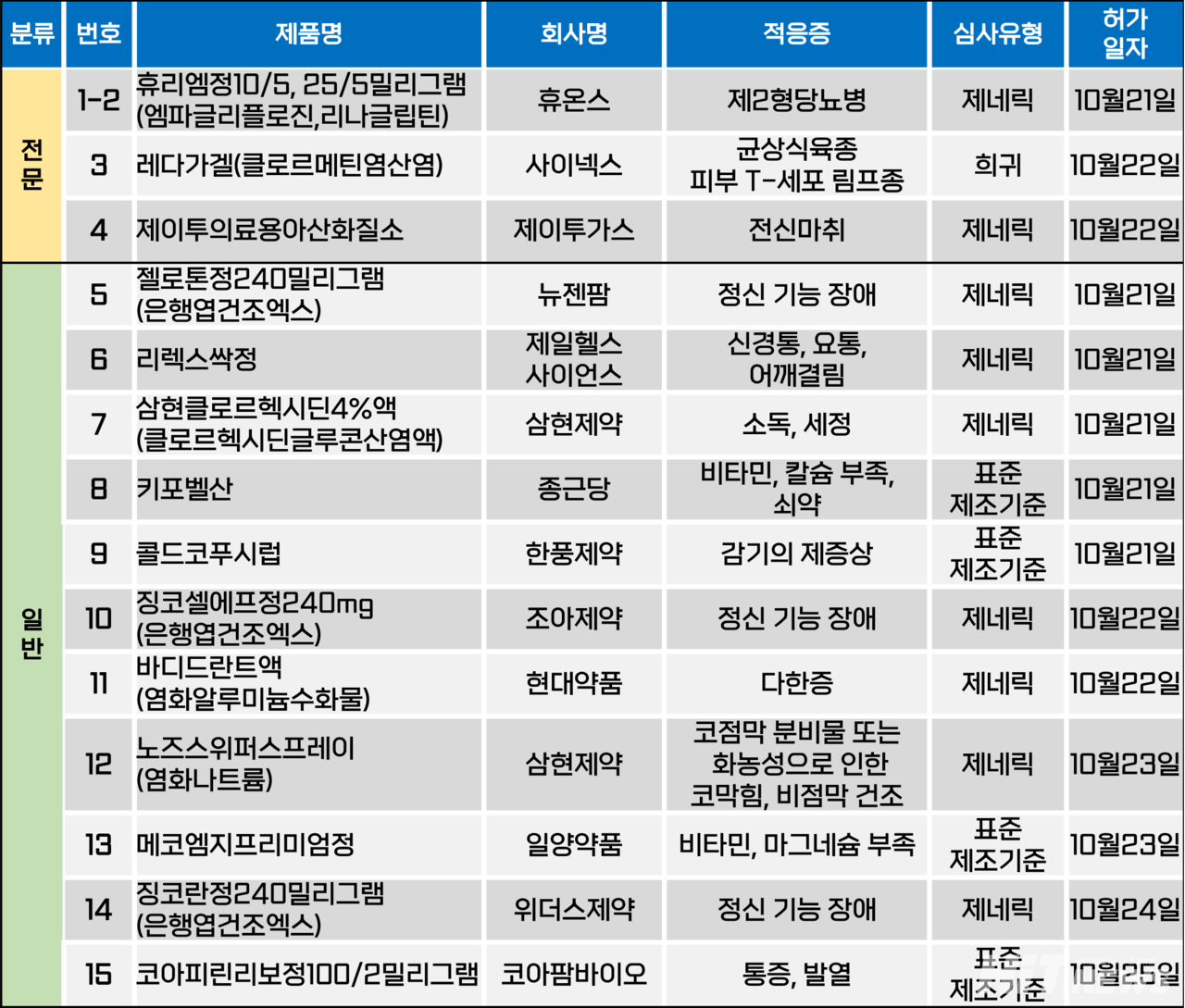
지난주(10월 21~25일) 총 15개 품목이 식품의약품안전처에서 품목허가를 받았다. 전문의약품은 4개, 일반의약품은 11개 품목이다. 이들은 제2형당뇨병, 균상식육종 피부 T세포 림프종, 정신 기능 장애 등 다양한 적응증으로 허가됐다.
스위스 제약사 '헬신 파마슈티컬스(Helsinn pharmaceuticals)'가 개발한 '레가다(성분 클로르메틴염산염)'가 국내 허가됐다.
사이넥스는 지난 22일 레가다를 균상식육종 피부 T세포 림프종(MF-Type CTCL) 국소 치료제로 허가 받았다. 이전에 피부직접요법을 받은 초기 균상식육종 피부 T세포 림프종 성인 환자의 경우 사용할 수 있다.
비호지킨 림프종의 일종인 균상식육종 피부 T세포 림프종은 국소 부위에 오래 지속되며, 가려움을 동반되는 발진을 유발하고, 추후 결절로 발전해 주위로 퍼지는 특성을 가진 질환이다. 광선 치료, 스테로이드 등 국소 약물, 항암화학요법제 등이 치료에 사용되고 있다.
이번에 허가된 레다가는 클로르메틴 성분의 알킬화제로, 겔 형태의 국소 도포제다. 알킬화제는 암세포가 분열하는 동안 그 DNA와 결합해 세포 분열을 막아 성장 억제 및 사멸시키는 작용기전을 가진다.
유럽의약품청(EMA) 허가 정보에 따르면, 레다가의 허가는 2006년부터 2011년 8월까지 진행된 '210 연구'를 통해 이뤄졌다. 이 연구는 260명의 환자를 0.02% 크롤르메틴 겔 및 기존 연고 제형(제품명 카리오리신)의 효과를 비교했다. '병변 부위 중증도 종합평가 점수(CAILS)'로 평가한 결과, 최소 6개월 이상 레다가로 치료받은 환자의 58%(76/130명)에서 유의미한 효과가 도출됐으며, 이는 연고로 치료받은 환자 48%(62/130명)에 비해 개선된 결과다.
한편, 레다가는 지난 2013년 8월 미국 FDA, 2017년 3월 유럽 EMA로부터 허가된 바 있다. 미국에서는 발클로르(Valchlor)라는 상품명으로 출시됐으며, 유럽에서는 국내와 같이 레다가로 출시했다.
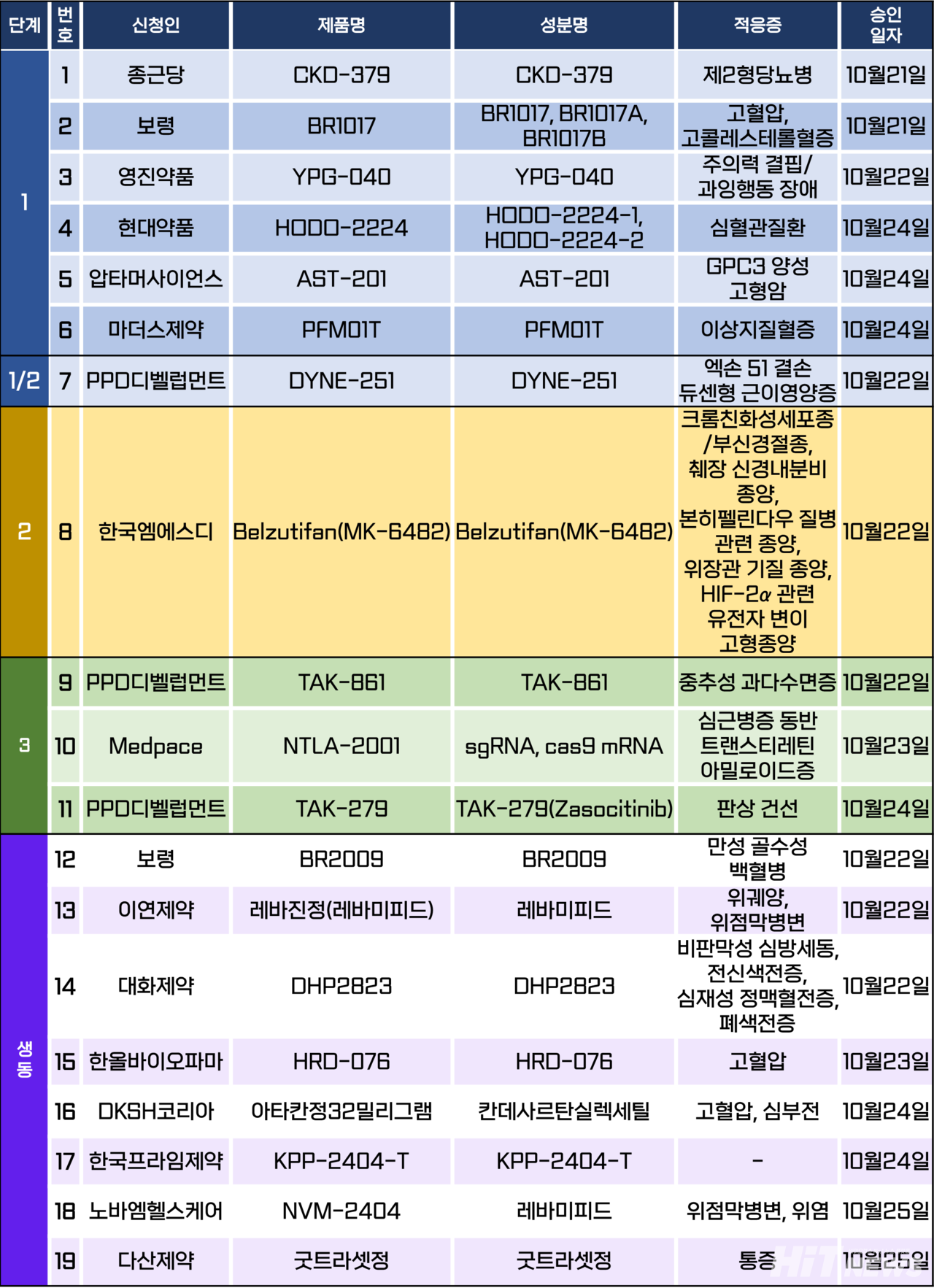
임상시험계획은 총 19건이 승인됐다. 세부적으로 △1상 6건 △1/2상 1건 △2상 1건 △3상 3건 △생물학적 동등성 8건 등이다.
이 임상시험들은 고혈압, 이상지질혈증, 제2형당뇨병, 중추성 과다수면증, 트랜스티레틴 아밀로이드성 심근병증(ATTR-CM), 판상 건선 등 질환과 GPC3 양성, HIF-2α 관련 유전자 변이 등이 발생한 고형암을 대상으로 승인됐다.