디지털의료제품법 시행...신규 업체 GMP 신청 방법은?
|
식약처, 지난 24일부터 법 시행...임상시험·제조품질 관리방안 마련 |
우리나라가 세계에서 최초로 제정한 '디지털의료제품법'이 지난 24일부터 시행됐다.
디지털의료제품법은 지능정보기술, 로봇기술 등 디지털기술이 적용된 디지털의료기기, 디지털융합의약품 및 디지털의료·건강지원기기 등 디지털의료제품의 임상시험, 허가, 사후 관리 등 전반에 대한 규제 체계를 구축하기 위해 마련됐다.
31일 식품의약품안전처가 마련한 '디지털의료제품 법령 시행에 따른 업무 안내서'를 보면 업 허가, 허가·인증·신고, 임상시험, 제조 및 품질관리(GMP) 등이 담겼다.
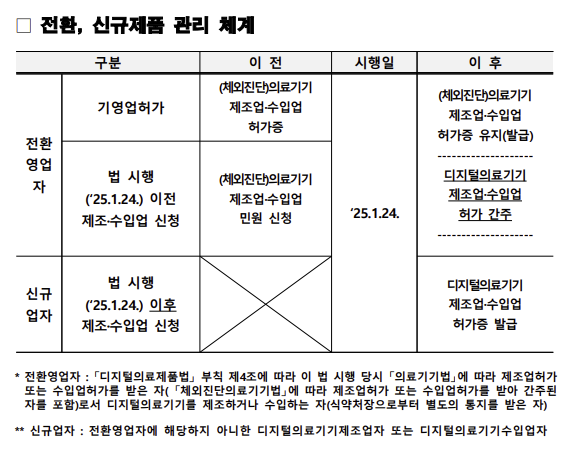
우선 디지털의료제품 업자 허가와 관련, 디지털의료기기에 해당하지 않는 의료기기를 취급했던 의료기기 업자가 디지털의료기기를 다루려면 신규 영업허가를 받아야 한다.
디지털의료제품법 시행 전에 디지털의료기기를 제조, 수입하고 있었으나 식약처로부터 통보받지 못한 경우에는 디지털의료제품 콜센터를 통해 관련 품목의 정보를 제공해야 한다. 이후 식약처가 검토 후 추가 조치를 진행하게 된다.
디지털의료기기로 전환되는 품목 허가를 보유한 의료기기 제조 또는 수입업체의 경우 업 허가가 그대로 유지되며 별도의 민원 신청을 통해 디지털의료기기 업 번호를 새로 부여 받을 수 있다.
디지털의료제품의 경우에도 GMP 적합판정서가 필요하다. 기존 의료기기 및 체외진단의료기기 GMP 적합인정서가 유효한 경우 디지털의료기기 GMP 적합판정 받은 것으로 간주하지만 정기심사에서 전환돼야 한다.
예를 들어 기존 의료기기 또는 체외진단의료기기 GMP 유효기간 만료일까지 판매가 가능하지만, 정기심사를 통해 디지털 GMP로 전환하지 않을 경우 더 이상 의료제품을 판매할 수 없다.
신규업체는 GMP 적합판정서가 필요함, 심사는 인증 업무 대행기관인 한국의료기기안전정보원에 해야 한다.
최초 심사의 경우 제조업자 및 제조원은 최소 1개 제조단위 이상의 품질관리 실적을 보유해야 하며, 현장조사 희망일은 조사일로부터 20일 이전까지 확정 신청해야 한다.
정기심사는 적합판정서 유효기간 만료 3개월 전까지 신청서를 제출해야 하며, 현장조사 희망일은 유효기간 만료일 20일 이전으로 확정이 필요하다.
https://www.dailypharm.com/Users/News/NewsView.html?ID=319995